- “Alles met de juiste mate”
- Geassocieerde symptomen
- Geassocieerde ziektebeelden
- Introductie postprandiale ontstekingsreactie
- Immuunactiviteit bij (vaak) eten en drinken
- Immuunactiviteit lager bij bekende voedingsmiddelen
- Immuunactiviteit heeft ook positieve effecten
- Deze drie belangrijkste uitlokkers van een PPIR
- Het verloop van een PPIR:
- Eiwit in voeding reduceert de PPIR
- Kwaliteit van eiwit is belangrijk
- Vetzuren in belans
- Bewegen voor het eten reduceert PPIR
- Het moderne westerse voedingspatroon
- Conclusie
- Bronnen
“Alles met de juiste mate”
Geassocieerde symptomen
- Buikvet
- Chronische ontstekingen en pijnen
- Concentratiestoornissen na het eten
- Hypertensie
- Onbedwingbare trek in zoetigheid
- Spierblessures
- Vermoeidheid en futloosheid na het eten
- Zeer snelle hartslag (tachycardie)
- Alle verdere hypothalamusafhankelijke stoornissen zoals gebrekkige thermoregulatie
Geassocieerde ziektebeelden
- Alle ziektebeelden die gepaard gaan met ontstekingen
- Alzheimer
- Chronisch Vermoeidheidssyndroom (CVS)
- Diabetes Mellitus type 2
- Fibromylagie
- Functioneel hypothalamus syndroom
- Hart- en vaatziekten
- Metabool syndroom
- Parkinson
Introductie postprandiale ontstekingsreactie
Een ontstekingsreactie na iets eten en drinken wordt postprandiale ontstekingsreactie (PPIR) genoemd. Dit komt voort uit onze evolutionaire achtergrond aangezien er in het voedsel dat we aten en het water dat we dronken in principe altijd bacterieën en virussen zaten.
Het belang van de postprandiale toestand is wetenschappelijk erkend, aangezien hyperglycemie en hyperlipidemie verband houden met verschillende chronische systemische laaggradige ontstekingsaandoeningen. Mensen brengen meer dan 16 uur per dag door in de postprandiale toestand en de wordt bepaald door een complex samenspel tussen voedingsstoffen, hormonen en van voeding afgeleide metabolieten (27).
Dat wij ons na het eten moe en slap voelen heeft ook met deze ontstekingsreactie te maken. Vanwege de al enorme ontstekingsbelasting door het moderne leven is het van belang dat we de onstekingsreactie bij (schoon) eten en drinken zo klein mogelijk houden en bovenal niet te vaak hebben.
Afbeelding uit (2019) “Human Postprandial Nutrient Metabolism and Low-Grade Inflammation: A Narrative Review” (27).
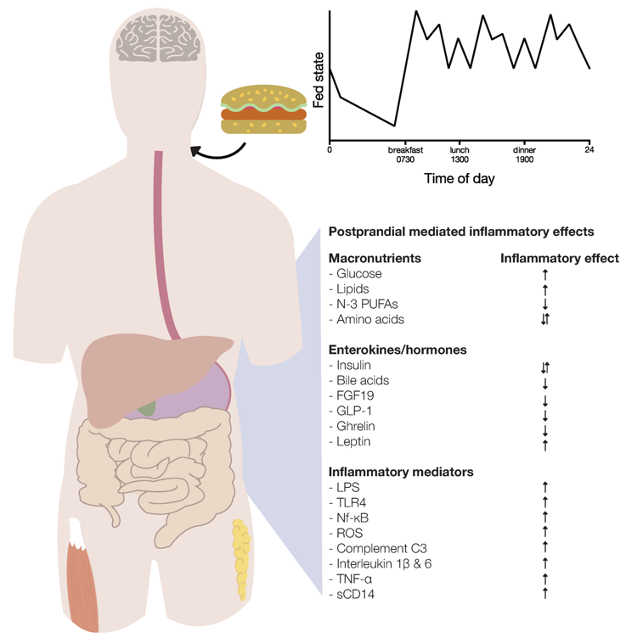
Verduidelijking afbeelding : De postprandiale ontstekingsreactie karakteriseert endocriene, metabolische en inflammatoire effecten. Inname van glucose en lipiden induceert postprandiale ontsteking, terwijl aminozuren pro- en ontstekingsremmende effecten hebben. Tijdens de postprandiale periode komen de enterokinen insuline, galzuren, fibroblast groeifactor 19 (FGF19), glucagon-achtige peptide-1 (GLP-1) en ghreline vrij en oefenen ze ontstekingsremmende effecten uit op het postprandiale onstekingsreactie. Leptine medieert negatieve effecten in vetweefsel. Insuline heeft ook pro-inflammatoire effecten. Bovendien, als gevolg van de opname van voedingsstoffen, verschillende mechanismen (dwz lipopolysacharide (LPS), Toll-like receptor 4 (TLR4), nucleaire factor kappa-lichtketen-enhancer-van geactiveerde B-cellen (Nf-KB), reactieve zuurstof soorten (ROS), complement component factor 3 (C3), interleukines, tumornecrosefactor (TNF)-α en oplosbaar CD14 worden geactiveerd of geproduceerd en stimuleren postprandiale ontsteking.
Immuunactiviteit bij (vaak) eten en drinken
Hoe komt het dat ons immuunsteem na een maaltijd zo sterk geactiveerd wordt? Het spijsverteringsstelsel moet dagelijks meerdere malen een moeilijke taak uitvoeren. De voedingsstoffen uit het eten moet door de darmwand heen naar de bloedbaan worden getransporteerd, en tegelijkertijd moet ons lichaam beschermd worden tegen gifstoffen, baterieën en virussen in dat eten. Eten, maar ook drinken, was tot voor kort een vrij hachelijke ondernemening, omdat zowel voedsel als water vol zaten met gevaarlijke virussen en bacterieën. Koelkasten bestonden niet, er werd niet hygienisch gewerkt bij het bereiden van voedsel en water werd gehaald op plaatsen waar ook dieren dronken. Pas in de laatste decennia zijn de omstandigheden waaronder voedsel wordt bereid, maar ook de opslagmogelijkheden, hygienischer geworden. Het is echter zo dat ons immuunsysteem dit (nog) niet weet.
Immuunactiviteit lager bij bekende voedingsmiddelen
Het is interessant om te zien dat hoe langer we tijden de evolutie al een voedingsmiddel eten, hoe minder ontstekingsreactie het uitlokt; kennelijk herkent ons lichaam het als een ‘oude bekende’ (3,4). Dit is uiteraard geen toeval, maar bioLOGISCH en het principe achter het paleolitische dieet. In het paleolithium dat 99% van onze evolutionaire geschiedenis beslaat leefden homo sapiens als jager-verzamelaar en visser. Dit veranderde vanaf 12.000 jaar geleden met het eindigen van de laatste ijstijd. Vanaf toen gingen we steeds meer aan landbouw doen, dat in west-Europa pas zo’n 6000 jaar geleden zijn intrede deed.
Het voedingspatroon was vroeger zeer nutrient rijk en enorm gevarieerd vol met duizenden verschillende groenten en kruiden, vissen, schaaldieren, knollen, noten, zaden, pitten, beenmerg, orgaanvlees, honing, insecten en afhankelijk van het seizoen veel fruit. Deze voeding was bovendien niet genetisch gemanipuleerd, zonder lichaamsverstorende c.q. onbruikbare bestandsdelen, hormonen, chemicalieën, pesticiden, metalen, maar nog wel met ‘goede’ bacterieën en voor de mens gezonde bestandsdelen die de plant (ter bescherming) aanmaakt, wanneer insecten er aan knabbelen. Een voorbeeld hiervan is brocolli en de zeer gezonde stof sulforafaan. Zo wijst onderzoek uit dat een niet biologische broccoli bijna geen sulforafaan bevat dat te maken heeft met het dus niet in contact komen met met insecten. Sulforafaan is een natuurlijk voorkomende inductor van fase II-enzymen om kankerverwekkende chemicaliën te ontgiften (28).
Al deze wezenlijke factoren dragen bij aan de darmflora en immuunactiviteit na voedselinname.
Immuunactiviteit heeft ook positieve effecten
Dat het immuunsysteem actief wordt om ons te beschermen is de meest voor de hand liggende reden. Er zit achter immuunactiviteit na eten ook een ander positief effect die wat complexer in elkaar steekt en zeer zeker een grote bijdrage is geweest voor de ontwikkeling van homo sapiens grote brein. Allereerst is het belangrijk om de weten dat de drie belangrijkste factoren die een PPIR uitlokken hoog calorische maatlijden (225 kal/100 gr), hoge vetrijke maaltijden (>40 gr / maaltijd) en hoge fructose maaltijden (>10% / maaltijd) zijn.
Deze drie belangrijkste uitlokkers van een PPIR
De drie belangrijkste uitlokkers hebben 1 ding gemeen; ze zijn vet of verantwoordelijk voor de vorming van vet (fructose). Vet is het belangrijkste bestandsdeel van de hersenen, en precies om die reden leidt het eten van vet tot een PPIR. Het is dus van groot belang voor de hersenen (6,7), maar tevens is vet een mogelijk schadelijk voedingsmiddel (8). Als mensen vet eten kan dat vele bacterieën en andere pathogenen bevatten die bijvoorbeeld een meningitis (hersenvliesontsteking) kunnen veroorzaken. De oplossing is simpel. Op het moment dat een grote hoeveelheid vet (of vetvormers zoals fructose) binnenkomt, leidt dat tot een ontsteking die de hersenen en bepaalde daar aanwezige cellen informeert over de aanwezigheid van vet en de mogelijk ook aanwezige bacterieën. De hersenen zelf reageren met activatie van immuuncellen in de hypothalamus (daar waar verzadiging en eetlust worden gereguleerd) waardoor de bloed-hersen-barriere afgesloten wordt door immuuncellen en eventuele bacterieën de hersenen niet kunnen bereiken. Tegelijkertijd zorgt de hypothalamusontsteking ervoor dat er geen verzadiging meer optreedt, waardoor de mens in kwestie zoveel mogelijk vet kan eten waardoor de hersenen zich kunnen voeden en waar nodig kunnen groeien.
Het verloop van een PPIR:
Het verloop is dus als volgt (9,10):
1.Iemand eet bijv. vet, fructose, koolhydraten (voeding) dat correspondeert met (hersen)groei.
2.De hersenen registreren dit via smaakreceptoren op de tong.
3.De voeding komt in de maag en produceert een ontstekingsreactie.
4.De onstekingsfactoren informeren de immuuncellen in de hersenen (hypothalamus)
5.De hypothalamus ontsteekt en de immuncellen in de hersenen zijn nu geactiveerd.
6.Het verzadiginggevoel verdwijnt en we kunnen blijven dooreten.
7.Eventuele bacterieën in de vette voeding komen de hersenen niet binnen (door het geactiveerde immuunsysteem) waardoor de hersenen zijn beschermd tegen infectie.
8.De ontsteking in de hersenen zelf activeert de HPA-as.
9.De HPA-as produceert nu een aantal stoffen (hormonen) waarvan binnen dit concept, ACTH en cortisol van belang zijn. ACTH beschermt de hersenen tegen verdere ontsteking en cortisol remt de ontstekingsreactie in de periferie.
10.De PPIR wordt beëindigd en de vette maaltijd heeft gezorgd voor hersengroei omdat, na het beëindigen van de ontstekingsreactie in de hypothalamus, bepaalde stamcellen in de hersenen (tanycyten) o.a. de hypothalamus repareren.
Eiwit in voeding reduceert de PPIR
Terwijl vet en grote hoeveelheden glucose en fructose (die omgezet worden in vet) een PPIR veroorzaken en de verzadiging remmen, zijn eiwitten juist in staat om verzadiging teweeg te brengen. De hoeveelheid eiwit die we binnenkrijgen speelt voor het gevoel van verzadiging en voor de hoogte van de vetwaarden en ontstekingsmarkers in het bloed een centrale rol. Hoe hoger het aandeel eiwit in een maaltijd in verhouding tot de hoeveelheid vet en koolhydraten, hoe geringer de ontstekingsreactie na het eten is, wat duur en intensiteit betreft (11).
Kwaliteit van eiwit is belangrijk
Naast hoeveelheid is ook de herkomst van het eiwit van belang. Eiwitten uit melkproducten (caseïne) of glutenhouden voedingsmiddelen (graan) zijn bijvoorbeeld niet erg waardevol (12). Verder is ook kwaliteit een belangrijke factor. Vooral bij vlees kunnen de uit onderzoek gebleken grote verschillende effecten op de gezondheid verklaard worden door de kwaliteit ervan. Het lichaam reageert heel verschilend op vlees al naar gelang de herkomst van de dieren, hoe ze geleefd hebben en hoe ze gevoed zijn. Wild en biologisch vlees laten duidelijk veel geringere postprandiale ontstekingsreactie zien dan vlees van vee, dat is vetgemest met het zogenaamde ‘krachtvoer’ (13).
Vetzuren in belans
Niet alleen het soort eiwit (de bron) is van belang. Ook het soort vetzuur heeft invloed op de processen die hiervoor besproken zijn. Daarom speelt de verhouding tussen de verschillende vetzuren (8) een belangrijke rol. Aan de ene kant zijn er de ontstekingsremmende omega-3-vetzuren EPA en DHA, aan de andere kant de ontstekingsbevorderende omega-6-vetzuren (linolzuur), de enkelvoudige onverzadigde vetzuren, de verzadigde vetzuren en de onnatuurlijke transvetten die schadelijk zijn. Hoe hoger de hoeveelheid omega-3-vetzuren EPA en DHA, hoe geringer de ontstekingsreactie (14-18).
Behalve het eten van vis, zeevruchten en noten is het van groot belang om te letten op de hoeveelheid plantaardige olie die in het eten wordt gebruikt, en op de vetzuurverdeling van de olie (19). Zo wordt zonnebloemolie dat zeer hoog is in omega-6 overal aan toegevoegd.
Een heel bijzondere plaats neemt olijfolie in. Maar hier zijn het niet de omega-9-vetzuren, maar de polyfenolen die de ontstekingsreactie significant verlagen (13). Ook andere polyfenolrijke voedingsmiddelen zoals bijvoorbeeld besssen hebben die eigenschap. Wat de koolhydtaten betreft gaat het volgens zeer recent onderzoek vooral om twee zaken: hoe hoger de glycemische waarde en glycemische lading van een voedingsmiddel, hoe sterker de ontstekingsreactie na het eten (20).
Bewegen voor het eten reduceert PPIR
Behalve de verhouding tussen de bestandsdelen en de kwaliteit van het eten is ook beweging heel belangrijk. Er blijk een significant geringere onstekingsreactie na het eten op te treden wanneer mensen voor het eten bewegen (21). Deze volgorde stamt nog uit de oertijd toen de mensen eerst gingen vissen, jagen of verzamelen en de buit vervolgens opaten. Fysiologisch gezien zijn wij nog steeds vissers, jagers en verzameleaars. Beweging in hongertoestand lokt de productie van de boodschapperstoffen IL-6, IL-8 en IL-15 uit. Zij informeren het immuunsysteem over het cruciale belang van het spierstelsel op dat moment, waardoor onze afweercellen vervolgens de evolutionaire gezien allersterkste beschermstof vormen die we kennen: lactoferinne (22). Deze substantie bestrijdt zeer effectief bactierieën, virussen en woekerende cellen, reguleert ontsteking en onderdrukt pijn. De mens moest als een van de langzaamste zoogdieren bij gevaar altijd verticaal vluchten (een boom in). Dat is vermoedelijk de reden waarom bij activiteit van de armspieren duidelijk meer beschermstoffen gevormd worden dan bij beweging van de benen (23). Met andere woorden: Als we de postprandiale ontstekingsreactie effectief willen onderdrukken moeten we voor het eten onze armspieren flink belasten, bijvoorbeeld door opdrukken, optrekken, boomklimmen of andere oefeningen. Hoe lang dat duur maakt niet zoveel uit (24), maar het moment voor het eten waarop oefeningen gedaan moeten worden om een positief effect op de ontstekingsreactie te hebben, moet wel binnen een periode van twee uur voor de maaltijd liggen (11). Dat geeft wel aan, hoe belangrijk beweging voor de de maaltijd is om de ontstekingsreactie te onderdrukken.
Het moderne westerse voedingspatroon
Mensen in de westerse wereld eten over het algemeen minstens vijf keer per dag. Overigens zijn tussendoortjes ook maaltijden en dit geldt net zo voor fruit. Het spijsversteringsstelsel komt daardoor nauwelijk tot rust. Een door de opname van voedsel uitgelokte ontsteking heeft, afhankelijk van de bovengenoemde factoren, bijna zeven uur nodig om weer tot rust te komen (14). Als we bovenop minder goede voeding ook nog eens minstens ‘s ochtends, ‘s middags en ‘s avonds eten, verkeren we in feite de hele dag in een ontstekingstoestand, die vaak ook nog door stress of ziekten versterkt wordt. De gevolgen hiervan zijn dagelijks oplopende waarden van triglyceriden, glucose en ontstekinsmarkers in het bloed, gedurende 18 uur of langer. Veel mensen weten heel vaak niet dat ze sterk verhoogde triclyceride- en glucosewaarden hebben, omdat de metingen meestal gebasseerd zijn op nuchtere afgenomen bloed. Er is een onmiskenbaar verband tussen deze biomarkers en diabetes mellitus type 2 (25), hoge bloeddruk, arteriosclerose en andere ontstekingsziekten (20,26). Vaak eten op een dag is een van de betrouwbaarste manieren om een mens zo snel mogelijk ziek te krijgen. De bewering dat vele kleine maaltijden per dag gezond zijn, is een van de meest onwetenschappelijke stellingen van de afgelopen decennia.
Conclusie
Een van de meest effectieve maatregelen die ziekte, maar ter preventie ook gezonde mensen zouden moeten nemen, is het eten van voedingsmiddelen met een zo laag mogelijke kans op een onstekingsreactie, zeker als ze daarbij ook een lage maaltijdfrequentie aanhouden. Van een lage maaltijdfrequentie spreken we wanneer niet dagelijks drie of meer maaltijden worden gegeten. Af en toe (1-2 keer per maand) is het juist goed om een lekker vette calorierijke maaltijd te genieten. De dag daarop zou men dan moeten vasten en daarmee zou het normale ritme van homo sapiens herstelt kunnen worden.
Bronnen
(1) Naylor, Richard & Hayes, Chris & Egger, Garry. (2012). The Relationship Between Lifestyle, Metaflammation, and Chronic Pain: A Systematic Review. American Journal of Lifestyle Medicine. 7. 130-137. 10.1177/1559827612451710.
(2) Wells J. C. (2012). The evolution of human adiposity and obesity: where did it all go wrong?. Disease models & mechanisms, 5(5), 595–607. https://doi.org/10.1242/dmm.009613
(3) Raison, C. L., Lowry, C. A., & Rook, G. A. (2010). Inflammation, sanitation, and consternation: loss of contact with coevolved, tolerogenic microorganisms and the pathophysiology and treatment of major depression. Archives of general psychiatry, 67(12), 1211–1224. https://doi.org/10.1001/archgenpsychiatry.2010.161
(4) Manning, P. J., Sutherland, W. H., McGrath, M. M., de Jong, S. A., Walker, R. J., & Williams, M. J. (2008). Postprandial cytokine concentrations and meal composition in obese and lean women. Obesity (Silver Spring, Md.), 16(9), 2046–2052. https://doi.org/10.1038/oby.2008.334
(5) Schwab, U., Lauritzen, L., Tholstrup, T., Haldorssoni, T., Riserus, U., Uusitupa, M., & Becker, W. (2014). Effect of the amount and type of dietary fat on cardiometabolic risk factors and risk of developing type 2 diabetes, cardiovascular diseases, and cancer: a systematic review. Food & nutrition research, 58, 10.3402/fnr.v58.25145. https://doi.org/10.3402/fnr.v58.25145
(6) McNamara, R. K., & Carlson, S. E. (2006). Role of omega-3 fatty acids in brain development and function: potential implications for the pathogenesis and prevention of psychopathology. Prostaglandins, leukotrienes, and essential fatty acids, 75(4-5), 329–349. https://doi.org/10.1016/j.plefa.2006.07.010
(7) Montmayeur, J. P., & le Coutre, J. (Eds.). (2010). Fat Detection: Taste, Texture, and Post Ingestive Effects. CRC Press/Taylor & Francis.
(8) Kell, D. B., & Pretorius, E. (2015). On the translocation of bacteria and their lipopolysaccharides between blood and peripheral locations in chronic, inflammatory diseases: the central roles of LPS and LPS-induced cell death. Integrative biology : quantitative biosciences from nano to macro, 7(11), 1339–1377. https://doi.org/10.1039/c5ib00158g
(9) Maric, T., Woodside, B., & Luheshi, G. N. (2014). The effects of dietary saturated fat on basal hypothalamic neuroinflammation in rats. Brain, behavior, and immunity, 36, 35–45. https://doi.org/10.1016/j.bbi.2013.09.011
(10) Timmermans, S., Bogie, J. F., Vanmierlo, T., Lütjohann, D., Stinissen, P., Hellings, N., & Hendriks, J. J. (2014). High fat diet exacerbates neuroinflammation in an animal model of multiple sclerosis by activation of the Renin Angiotensin system. Journal of neuroimmune pharmacology : the official journal of the Society on NeuroImmune Pharmacology, 9(2), 209–217. https://doi.org/10.1007/s11481-013-9502-4
(11) O’Keefe, J. H., & Bell, D. S. (2007). Postprandial hyperglycemia/hyperlipidemia (postprandial dysmetabolism) is a cardiovascular risk factor. The American journal of cardiology, 100(5), 899–904. https://doi.org/10.1016/j.amjcard.2007.03.107
(12) Holmer-Jensen, J., Karhu, T., Mortensen, L. S., Pedersen, S. B., Herzig, K. H., & Hermansen, K. (2011). Differential effects of dietary protein sources on postprandial low-grade inflammation after a single high fat meal in obese non-diabetic subjects. Nutrition journal, 10, 115. https://doi.org/10.1186/1475-2891-10-115
(13) Arya, F., Egger, S., Colquhoun, D., Sullivan, D., Pal, S., & Egger, G. (2010). Differences in postprandial inflammatory responses to a ‘modern’ v. traditional meat meal: a preliminary study. The British journal of nutrition, 104(5), 724–728. https://doi.org/10.1017/S0007114510001042
(14) Margioris A. N. (2009). Fatty acids and postprandial inflammation. Current opinion in clinical nutrition and metabolic care, 12(2), 129–137. https://doi.org/10.1097/MCO.0b013e3283232a11
(15) Peairs, Abigail & Rankin, Janet & Lee, Yong. (2011). Effects of acute ingestion of different fats on oxidative stress and inflammation in overweight. Nutrition journal. 10. 122. 10.1186/1475-2891-10-122.
(16) Luu, N. T., Madden, J., Calder, P. C., Grimble, R. F., Shearman, C. P., Chan, T., Dastur, N., Howell, W. M., Rainger, G. E., & Nash, G. B. (2007). Dietary supplementation with fish oil modifies the ability of human monocytes to induce an inflammatory response. The Journal of nutrition, 137(12), 2769–2774. https://doi.org/10.1093/jn/137.12.2769
(17) Alipour, A., van Oostrom, A. J., Izraeljan, A., Verseyden, C., Collins, J. M., Frayn, K. N., Plokker, T. W., Elte, J. W., & Castro Cabezas, M. (2008). Leukocyte activation by triglyceride-rich lipoproteins. Arteriosclerosis, thrombosis, and vascular biology, 28(4), 792–797. https://doi.org/10.1161/ATVBAHA.107.159749
(18) Poppitt, S. D., Keogh, G. F., Lithander, F. E., Wang, Y., Mulvey, T. B., Chan, Y. K., McArdle, B. H., & Cooper, G. J. (2008). Postprandial response of adiponectin, interleukin-6, tumor necrosis factor-alpha, and C-reactive protein to a high-fat dietary load. Nutrition (Burbank, Los Angeles County, Calif.), 24(4), 322–329. https://doi.org/10.1016/j.nut.2007.12.012
(19) Perez-Herrera, A., Delgado-Lista, J., Torres-Sanchez, L. A., Rangel-Zuñiga, O. A., Camargo, A., Moreno-Navarrete, J. M., Garcia-Olid, B., Quintana-Navarro, G. M., Alcala-Diaz, J. F., Muñoz-Lopez, C., Lopez-Segura, F., Fernandez-Real, J. M., Luque de Castro, M. D., Lopez-Miranda, J., & Perez-Jimenez, F. (2012). The postprandial inflammatory response after ingestion of heated oils in obese persons is reduced by the presence of phenol compounds. Molecular nutrition & food research, 56(3), 510–514. https://doi.org/10.1002/mnfr.201100533
(20) Huffman, K. M., Orenduff, M. C., Samsa, G. P., Houmard, J. A., Kraus, W. E., & Bales, C. W. (2007). Dietary carbohydrate intake and high-sensitivity C-reactive protein in at-risk women and men. American heart journal, 154(5), 962–968. https://doi.org/10.1016/j.ahj.2007.07.009
(21) Pruimboom, L., Raison, C. L., & Muskiet, F. A. (2015). Physical Activity Protects the Human Brain against Metabolic Stress Induced by a Postprandial and Chronic Inflammation. Behavioural neurology, 2015, 569869. https://doi.org/10.1155/2015/569869
(22) Moreno-Navarrete, J. M., Ortega, F., Sabater, M., Ricart, W., & Fernández-Real, J. M. (2011). Proadipogenic effects of lactoferrin in human subcutaneous and visceral preadipocytes. The Journal of nutritional biochemistry, 22(12), 1143–1149. https://doi.org/10.1016/j.jnutbio.2010.09.015
(23) Helge, J. W., Klein, D. K., Andersen, T. M., van Hall, G., Calbet, J., Boushel, R., & Saltin, B. (2011). Interleukin-6 release is higher across arm than leg muscles during whole-body exercise. Experimental physiology, 96(6), 590–598. https://doi.org/10.1113/expphysiol.2010.056424
(24) Ferreira, A. P., Ferreira, C. B., Souza, V. C., Córdova, C. O., Silva, G. C., Nóbrega, O., & França, N. M. (2011). The influence of intense intermittent versus moderate continuous exercise on postprandial lipemia. Clinics (Sao Paulo, Brazil), 66(4), 535–541. https://doi.org/10.1590/s1807-59322011000400003
(25) Blackburn, P., Després, J. P., Lamarche, B., Tremblay, A., Bergeron, J., Lemieux, I., & Couillard, C. (2006). Postprandial variations of plasma inflammatory markers in abdominally obese men. Obesity (Silver Spring, Md.), 14(10), 1747–1754. https://doi.org/10.1038/oby.2006.201 (26) Klop, B., Proctor, S. D., Mamo, J. C., Botham, K. M., & Castro Cabezas, M. (2012). Understanding postprandial inflammation and its relationship to lifestyle behaviour and metabolic diseases. International journal of vascular medicine, 2012, 947417. https://doi.org/10.1155/2012/947417
(26) Klop, B., Proctor, S. D., Mamo, J. C., Botham, K. M., & Castro Cabezas, M. (2012). Understanding postprandial inflammation and its relationship to lifestyle behaviour and metabolic diseases. International journal of vascular medicine, 2012, 947417. https://doi.org/10.1155/2012/947417
(27) Meessen, E., Warmbrunn, M. V., Nieuwdorp, M., & Soeters, M. R. (2019). Human Postprandial Nutrient Metabolism and Low-Grade Inflammation: A Narrative Review. Nutrients, 11(12), 3000. https://doi.org/10.3390/nu11123000
(28) Tian, M., Xu, X., Hu, H., Liu, Y., & Pan, S. (2017). Optimisation of enzymatic production of sulforaphane in broccoli sprouts and their total antioxidant activity at different growth and storage days. Journal of food science and technology, 54(1), 209–218. https://doi.org/10.1007/s13197-016-2452-0





