- Symptomen bij een verminderde werking van de schildklier en schildklierhormonen
- Ziektebeelden die samenhangen met een trage schildklier
- Ziektebeelden die samenhangen met een te snelle schildklier
- Uitsluitingscriteria van een te trage schildklierwerking
- Introductie
- Oorzaken schildklier(hormoon) stoornissen
- Van futloosheid en minder intelligent tot fibromyalgie en autisme
- De hersenen sturen de schildklier aan
- Hoe de schildklier functioneert
- Low Thyroid Hormone Syndrome
- Reverse T3 en het missen van schildklierstoornissen
- T3 resistentie of ongevoeligheid
- Struma
- Auto-immuunziekten van de schildklier
- Hashimoto
- Graves
- Schildklier parameters bij stoornissen
- Aandachtspunten schildklierstoornissen
- Over de auteur
- Wetenschappelijke bronnen
“Centraal in stofwisseling en energie…”
Symptomen bij een verminderde werking van de schildklier en schildklierhormonen
Bewegingsarmoede
Bloeddrukstijging
Buikvet, overgewicht
Chronische vermoeidheid
Concentratiestoornissen
Cyclusklachten
Erectieproblemen
Futloosheid
Gebrek aan eetlust
Haaruitval
Koude handen en voeten
Libidoverlies
Spierkrampen
Slaapstoornissen
Stemminswisselingen
Verlaagde pijngrens
Ziektebeelden die samenhangen met een trage schildklier
Depressie
Hart- en vaatziekten
Metabool syndroom
Onvruchtbaarheid
Hashimoto
Ziektebeelden die samenhangen met een te snelle schildklier
Ziekte van Graves
Te hoge jodium inname
Uitsluitingscriteria van een te trage schildklierwerking
Geen huid- of haarproblemen
Geen vermoeidheid of futloosheid
Goed functionele thermoregulatie (niet snel koude handen of voeten en snelle aanpassing aan kou en warmte)
Normaal BMI passend bij leeftijd en geslacht
Introductie
Het schildklierhormoon behoort tot de oudste hormonen op aarde en is nog altijd (mede) verantwoordelijk voor de evolutie en ontwikkeling van alle levende wezens. Het is een hormoon die effecten heeft op de (brein)ontwikkeling, metabolisme en homeostase van organismen en uiteraard ook de mens (1).
Een van deze basiselementen, jodium, levert het belangrijkste materiaal voor de aanmaak van het schildklierhormoon (1). Homo sapiens haalde dit nutriënt vooral uit insecten, zeeleven (vis, wieren, schaaldieren), waterkantplanten, amfibieën, eieren en landdieren (orgaanvlees). Tegenwoordig wordt jodium toegevoegd aan tafelzout en brood. In 2004 verscheen er een rapport van de wereld gezondheidsorganisatie dat er in de westerse wereld veel mensen lijden aan een jodium tekort. Medisch contact berekende dat dit neer zou komen op zo’n 6 miljoen Nederlanders (2). Dit probleem is ‘onaangeraakt’ wat typerend is voor het beleid en vooral heel zorgelijk, aangezien dit tekort hoogstwaarschijnlijk nog net zo aanwezig is onder vele Nederlanders. De schadelijke gevolgen die hierdoor optreden zijn afhankelijk van de mate van het tekort en worden dadelijk helder beschreven. Alvast prettig om te weten dat een jodium tekort en ander problemen op het gebied van de schildklier, vaak eenvoudig zijn op te lossen en daardoor veel gezondheidswinst geven.
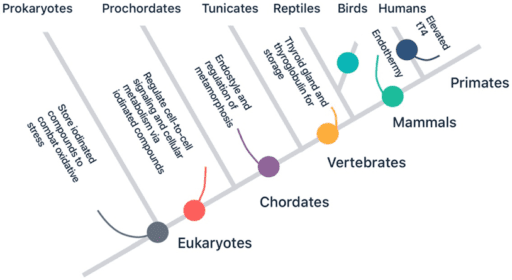
Uit: (2020). Reinterpreting patterns of variation in human thyroid function: An evolutionary ecology perspective: Een vereenvoudigde fylogenie van de schildklierfunctie te zien in de illustratie. De huidige opvatting is dat het vermogen om jodium, jodiden en gejodeerde verbindingen te gebruiken, teruggaat tot de prokaryote voorouder van al het eukaryote leven (organismen met cellen die een celkern bevatten). Uiteindelijk leidde selectiedruk op de schildklier bij mensen tot verhoogde totale T4-concentraties, in vergelijking met onze chimpansee-neven (3).
Oorzaken schildklier(hormoon) stoornissen
We zien dat stoornissen van de schildklier veel voorkomen en vijf maal vaker bij vrouwen dan bij mannen. De schildklier staat zeer centraal in onze ‘energiehuishouding’ en dit belangrijke orgaan kan in de war raken door gebrek aan essentiële voedingsstoffen zoals jodium, zink en selenium, maar ook door te veel óf te weinig te eten. Problemen op het gebied van (het hebben van) energie treden dan op.
Extra belastend en factor is dat dat de schildklier en het menselijk lichaam (in de 21ste eeuw) blootgesteld aan stoffen zoals medicijnen, drugs, pesticiden, plastics, zware metalen en ander (potentieel) vergif en steeds meer onderzoek laat zien, bij zowel dieren als mensen, dat dit een aanzienlijke rol speelt in gezondheid en ziekte. Deze stoffen zijn overal en in het leven anno nu onvermijdelijk. Plastic deeltjes komen in de lucht en accumuleren in onze omgeving en natuur (4). Zo worden nanoplastics gevonden in het ijs op zowel de noord als zuidpool (5). Recent Nederlands onderzoek wijst uit dat het door het bloed van de meeste onderzochten stroomt (6). Een aantal van deze stoffen lijken namelijk qua structuur op schildklierhormoon typen T3 en T4 en verstoren daarmee de normale werking. Bisfenol A (BPA) wat in plastics zit, is een van ’s werelds meest gebruikte chemicaliën in voedselverpakkingen, voering van voedselblikjes, speelgoed, tubes, cosmetica, enzovoorts (7). Omdat BPA niet chemisch gebonden is aan het materiaal, kan het gemakkelijk met voedsel of dranken mengen en met name na herhaald gebruik, fysieke manipulatie (wrijving) of vrijkomen door hitte (7).
Onderzoek laat zien dat BPA de functie (werking) van het het schildklierhormoon verlaagt op verschillende manieren: het vermindert de opname van schildklierjodide, verlaagt het enzym dat het schildklierhormoon aanmaakt (TPO-activiteit omlaag) en verandert de genexpressie (epigenetica) voor eiwitten die betrokken zijn bij de synthese van schildklierhormoon (7). Bovendien is BPA een antagonist van schildklierhormoonreceptoren (7).
Recent verscheen een Iranese studie die een verband liet zien tussen fluoride in het drinkwater en hypothyreoïdie (verlaagde spiegels TSH en T3). De onderzoekers raden aanvullende waterzuivering aan voor mensen die lijden aan hypothyreoïdie (8). In Nederland wordt het water niet gefluorideerd maar de tandpasta bevat wel fluoride, waardoor we het kunnen binnenkrijgen. Een punt van overweging bij mensen met hypothyreoïdie.
‘Last but not least’ is chronische stress en ontsteking (inflammatie) dat bijdraagt aan de verstoring van de schildklier en functie van het schildklier hormoon. Zo laat onderzoek zien dat subklinische (‘milde’) hypothyrodie verband heeft met laaggradige ontsteking en voorspelt cardiovasculaire ziekte bij mannen onder de 50 jaar (9). Overigens werd deze ‘light’ versie van hypothyrodie waargenomen bij 20% van de algemene bevolking (9). Zoals gezegd komen gezondheidsproblemen omtrent de schildklier veel voor.
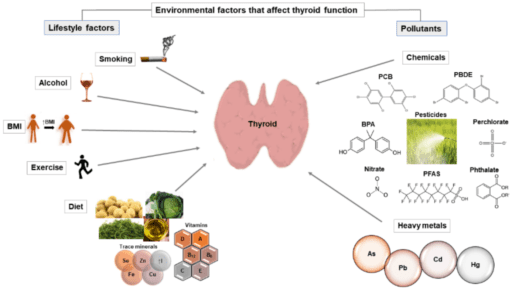
Uit: (2021). Environmental Factors Affecting Thyroid-Stimulating Hormone and Thyroid Hormone Levels (7).
Van futloosheid en minder intelligent tot fibromyalgie en autisme
Een mild tekort (of disfunctie van het schildklierhormoon) al leiden tot gezondheidsschade, zoals verminderde intellectuele capaciteiten (lager IQ) en dit nutriënt speelt waarschijnlijk een rol in de pathogenese van syndromen als fibromyalgie, het chronisch vermoeidheidssyndroom, ADHD en autisme (2, 10, 11). Het schildklierhormoon is essentieel voor hersengroei en hersenfunctie en het is dus enorm belangrijk dat dit hormoon goed functioneert tijdens de zwangerschap voor goede (brein)ontwikkeling van het kind (12). Zijn de hersenen minder ontwikkeld en is een ontwikkelingsstadium ‘gemist’, dan is dit niet of nauwelijks te herstellen. Ontwikkelingsstoornissen worden steeds meer gezien en 1 op de 10 kinderen in de Verenigde Staten krijgt tegenwoordig de diagnose autisme of ADHD. Het veranderde habitat en dieet door onze voorouders en de daarbij gepaarde toename van de consumptie van jodiumrijk(er) voedsel, is een van de factoren waarom onze hersenpan en intelligentie zo kon toenemen (3, 12). Deze verbanden lijken wellicht losse puzzelstukjes, echter met de verbindende lijm ‘evolutionaire biologie’, zien we een passend plaatje. Laten we dit plaatje verder bekijken en lezen hoe de schildklier wordt aangestuurd via hormonen vanuit de hersenen.
De hersenen sturen de schildklier aan
In evolutionaire geneeskunde (kPNI) wordt de relatie tussen verschillende systemen en organen onderzocht en beïnvloed ter behoeve van gezondheid en de genezing van ziekte. Balans of homeostase herstellen is daarbij een centraal uitgangspunt en ook ‘taak’ die de hersenen en bij uitstek de hypothalamus in het menselijk lichaam vervult. Afgaan van homeostase is onvermijdelijk en via de verschillende assen, activeren de hersenen via de hypothalamus en hypofyse betreffende doelorganen in een poging het lichaam te reguleren. De verbinding naar de schildklier heet ook wel de hypothalamus-hypofyse-schildklier-as of HPT-as (Engels: hypothalamus-pituitary-thyroid-axis).
In onderstaande illustratie zien we hoe naast de schildklier (in het plaatje links) ook andere assen worden aangestuurd vanuit de hersenen (13). Deze assen zijn een complexe set met directe feedback en indirecte feedback tussen drie componenten: de hypothalamus, de hypofyse en de doelorganen, zoals de schildklier, bijnieren, borstklieren, lever, teelballen en eierstokken. De meest bekende as is de HPA-as. Onder stress is deze as ervoor om cortisol aan te maken.
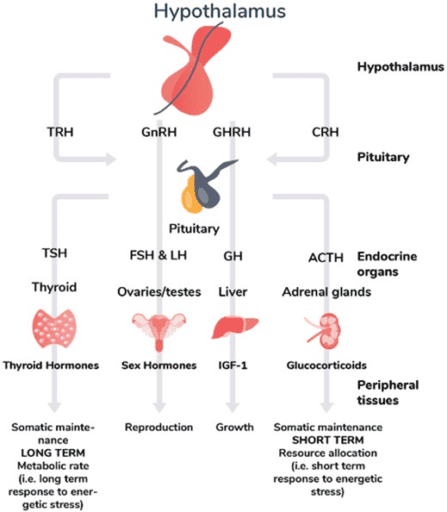
Uit: (2020). Reinterpreting patterns of variation in human thyroid function: An evolutionary ecology perspective (3).
De hypothalamus maakt TRH aan wat leidt tot de aanmaak van TSH in de hypofyse, dat in de schildklier leidt tot de productie van T4 (Thyroxine en T3 (Tri-joodthyronine)
Hoe de schildklier functioneert
In de schildklier wordt uit het aminozuur L-tyrosine door de binding aan vier jodiumatomen – via enkele voorstadia het minder actieve schildklierhormoon T4 gevormd. Ijzer is een belangrijke bijkomende factor bij de vorming. Uit het minder actieve T4 kunnen vervolgens de twee meest actieve, maar in hun functie tegengestelde schildklier hormomen T3 (activatie) en reverse T3 (rT3, remming) worden gevormd.
Terwijl T4 uitsluitend in de schildklier wordt geproduceerd, ontstaan T3 en rT3 voor ongeveer 80% in andere delen van het lichaam. Daarbij wordt door het enzym dejodinase een jodiumatoom van T4 afgesplitst, terwijl voor de synthese van T3 selenium noodzakelijk is, wordt rT3 selenium onafhankelijk geproduceerd. Een gebrek aan selenium kan de T3 synthese dus dwarsbomen. Ondanks het feit dat alle organen T3/rT3 kunnen produceren, worden deze typen schildklierhormoon vooral in de lever geproduceerd. Dit betekent dat bepaalde stoornissen van leverfunctie veranderingen in de schildklierstofwisseling kunnen veroorzaken.
Het stofwisselingsactiverende T3 maakt het mogelijk dat spieren en organen ‘toestemming’ krijgen om meer energie te verbruiken. Daarentegen is rT3 juist verantwoordelijk voor een reductie van het energieverbruik.
Bijna al onze cellen hebben receptoren (TR) om opdrachten van het schildklierhormoon te ontvangen. Veel schildklierhormoon T3 betekent dat we goed gedijen en groeien. Maar als we in verhouding meer rT3 produceren dan T3, dan wordt overgeschakeld op de evolutionaire spaarmodus, omdat het lichaam denkt dat er gevaar is. Op gevaar moet voorbereid worden door het sparen van energie. Het lichaam probeert bij een aanhoudende hoge rT3-status de stofwisseling steeds verder te reduceren, vergelijkbaar met die van reptielen, waardoor we het zogenaamde reptielen fenotype-syndroom ontwikkelen. We verliezen haar, hebben het snel koud en krijgen koude handen en voeten of ervaren warmte als heel onaangenaam, kunnen nauwelijks onze lichaamstemperatuur reguleren en onze huid wordt lederachtig, droog en rimpelig. Een verminderde vruchtbaarheid is een van de opvallendste gevolgen van een verminderde schildklieractiviteit, zonder dat de schildklier zelf ziek is (LTHS – Low Thyroid Hormone Syndrome; bronnen 14, 15).
In onze geschiedenis heeft dit oeroude mechanisme homo sapiens in tijden van gevaar en tekorten, vele voorouders gered van de dood. Vandaag de dag met de overvloed aan eten en dus energie, werkt dit mechanisme eerder in ons nadeel.
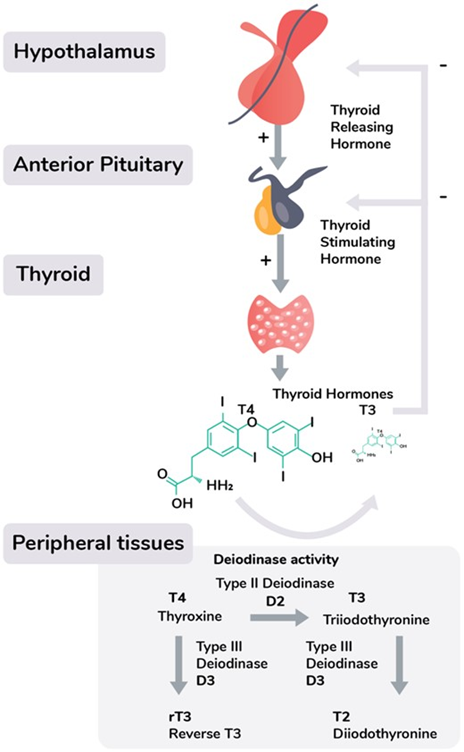
Uit: (2020). Reinterpreting patterns of variation in human thyroid function: An evolutionary ecology perspective (3).
Low Thyroid Hormone Syndrome
Het syndroom van een verminderde schildklierhormoon activiteit (LTHS) is het voorstadium van ‘niet-schildkier gebonden ziekten’ (Non Thyroidal Illnes Syndrome, NTIS) en wijst op een teveel aan rT3 in verhouding tot T3, ook als er geen sprake is van een directe schildklieraandoening. Het is dus onderdeel van een symptomencomplex dat doorgaans met de naam hypothyreodie ofwel traag werkende schildklier wordt aangeduid.
Bij bijna alle ernstige aandoeningen of tijdens acute of chronische stresssituaties kan een LTHS ofwel een verhoogde productie van rT3 worden vastgesteld, wat kan leiden tot verminderde activiteit van een of meerdere organen. Een langdurig verminderde orgaanactiviteit leidt tot verwaarlozingsziekten, ontstaan door een verminderde energietoevoer. Hart- en nierinsufficiëntie zijn daar voorbeelden van (16). Deze reacties ziet ons lichaam als noodzakelijk en zinvol om zich op de lange termijn te beschermen tegen orgaanfalen en dood.
Altijd wanneer T3-waarden te laag en rT3-waarden te lang verhoogd zijn, ontstaan er degeneratieve problemen die gepaard gaan met haaruitval, sneller grijs worden van het haar, rimpels, afbraak van steunweefsel, droge huid, enzovoorts.
De uitwerkingen van LTHS en langdurig verhoogde rT3-waarden zijn merkbaar door verschijnselen die in een voorspelbare volgorde optreden.
1. Niet levensnoodzakelijke organen en structuren worden afgebroken: spieren, bindweefsel (banden, pezen), haren, nagels.
2. Vitale organen (lever, nieren, spijsverteringsstelsel) worden geremd in hun functies.
3. De neocortex (deel van onze hersenen) o.a. voor het bewust verwerken van informatie en redeneren, krimpt.
4. De huid vernieuwt zich niet meer en verliest haar elasticiteit.
5. Het immuunsysteem wordt onderdrukt, waardoor een verhoogd risico op auto-immuunziekten ontstaat.
6. Longaandoeningen en hartziekten treden op.
De reden van het lichaam voor deze stoornissen is dat het lichaam zichzelf probeert te redden door energie te sturen, daar naar waar het energie nodig acht. Dit is gebaseerd op het verleden – biologische evolutie.
In onderstaande illustratie en wetenschappelijke bron (20) zien we hoe rT3 verband heeft met ernst van ziekte en mortaliteit, maar ook hoe andere type schildklierhormoon waarden kunnen variëren, afhankelijk van het stadium (van een ziekte) waarin een persoon zich verkeerd.
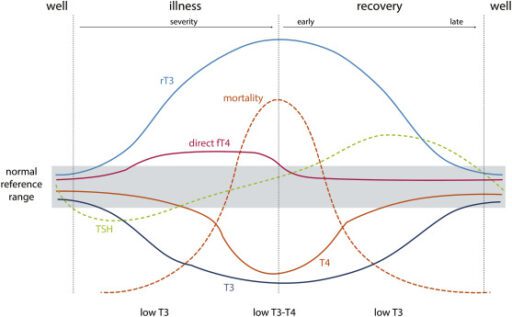
Uit: (2021). The hypothalamus-pituitary-thyroid (HPT)-axis and its role in physiology and pathophysiology of other hypothalamus-pituitary functions (20).
Typische veranderingen in schildkliertesten tijdens de ontwikkeling van en herstel van niet-thyroïdale ziekte en gerelateerd aan mortaliteit.
Reverse T3 en het missen van schildklierstoornissen
In de reguliere praktijk werd en wordt reverse T3 weinig gemeten, omdat het nog altijd wordt beschouwd als een niet-actieve vorm van T3. Uit nieuwe studies blijkt dat rT3 een ‘overwinteringshormoon’ is en functioneert als laatste redmiddel in tijden van gevaar om energie te sparen en op die manier het overleven te garanderen (17). Om daadwerkelijk vast te kunnen stellen in hoeverre de schildklier en het schildklier hormoon functioneert is het ook nodig dat rT3 gemeten wordt en in verhouding met de andere waarden. Dit is het beste biochemische bewijs voor de diagnose hypothyreodie (LTHS c.q. NTIS). Aanvullend met klinische symptomen kan de diagnose eventueel worden bevestigd. Zie verderop in de grafiek welke waarden regulier worden gebruikt om de schildklierstoornissen vast te stellen: Struma, Graves en Hashimoto.
Patiënten met een te trage werking kunnen jarenlang binnen de grenzen van de normale TSH- en T3 waarden blijven. Soms wordt zelfs een verhoogde T4 waarde gevonden die vervolgens tot de onjuiste diagnose van en te snel werkende schildklier (hyperthyreodie) kan leiden (18).
Een voor een te lage schildklierwerking (LTHS) typische laoratoriumuitslag laat een lage T3-waarde zien en een in verhouding duidelijk verhoogde rT3-waarde Vaak laten de T4 en TSH-waarden bij een bloedonderzoek geen afwijkingen zien (19).
T3 resistentie of ongevoeligheid
Als de receptoren voor T3 in een orgaan geblokkeerd zijn, dan kan T3 dat orgaan niet meer aanzetten tot de gewenste actie. Er ontstaan symptomen van hypothyreoïdie, maar in het bloed circuleert voldoende of zelfs te veel T3. In feite zijn de cellen dan T3-resistent geworden. Ook kan het zijn dat T4 niet voldoende in het actieve T3 wordt omgezet. TSH en T4 kunnen binnen de formele referentiewaarden vallen, terwijl er wel degelijk iets mis is met de schildklierhormonen. Bovendien wordt alleen vrij T4 en vrij T3 gemeten terwijl het grootste deel van het T3 en T4 gebonden is aan (transport)eiwitten in het bloed. Dit maakt het niet makkelijk om schildklierproblemen te diagnosticeren.
Struma
Vroeger zag men in gebieden die ver van de zee af lagen en waar de grond arm is aan jodium, vaak mensen met struma (krop). Bij struma – een vorm van hypothyreoïdie, is de schildklier vergroot in de hals en is in omvang zichtbaar. Gebrek aan jodium is meestal de oorzaak. Daardoor kan er niet voldoende T4 en T3 worden gemaakt. De hypofyse gaat dan in de hoogste versnelling om TSH te produceren, wat voor de opbrengst (hyperplasie) zorgt.
Auto-immuunziekten van de schildklier
Aanvullende informatie wordt gekregen door het meten van de antistoffen tegen TSH-receptoren, TPO en Tg. Anti-TPO en anti-Tg (thyroglobuline) zijn bij Hashimoto en Graves verhoogd. Dat wil niet zeggen dat zij de ziekteverwekkers zijn, maar waarschijnlijk zijn zij een reactie van het lichaam op de schade die is ontstaan aan de schildklier.
Hashimoto
De ziekte van Hashimoto is een auto-immuunziekte waarbij het immuunsysteem de schildklier aanvalt, die ontstoken raakt waardoor het weefsel verloren gaat. Ook bij Hashimoto is de hals gezwollen. De ziekte van Hashimoto heeft vaak hypothyreoïdie tot gevolg, al hoeft dit niet, de schildklier kan bij Hashimoto ook overactief worden of vrijwel normaal blijven functioneren. De ziekte kenmerkt zich door de antistoffen anti-TPO en anti-Tg in het bloed. De ziekte komt vaak tegelijk voor bij andere auto-immuunziektes zoals coeliakie en diabetes type-1. Consumptie van te veel jodium kan de ziekte van Hashimoto verergeren (21).
Graves
De meest voorkomende oorzaak van hyperthyreoïdie is de ziekte van Graves (ook wel de ziekte van Basedow). Dit is een auto-immuunziekte waarbij het afweersysteem een antistof produceert die sterk lijkt op TSH (anti-TSH-r). Deze antistof hecht zich aan de schildklier die overactief wordt. Door de hoge productie van T4 en T3 neemt de basale stofwisseling toe, waardoor iemand meer energie verbruikt, meer eetlust heeft en het constant warm heeft. Ook kenmerkend zijn een gejaagde hartslag of hartkloppingen, trillende handen en warme, vochtige handpalmen. Ook slapeloosheid en onrust kunnen bij de symptomen horen. Klassiek voor een onbehandelde ziekte van Graves is de verhoogde oogdruk, waardoor de ogen enigszins uit de oogkassen puilen. De ziekte komt voor bij mensen met een erfelijke aanleg, in combinatie met omgevingsfactoren zoals een doorgemaakte infectie, stress, roken of een andere auto-immuunziekte zoals diabetes type-1 of reumatoïde artritis (21).
Schildklier parameters bij stoornissen
Onderstaande parameters en betreffende referentiewaarden bij het vaststellen van Struma, Graves en Hashimoto. Voor rT3 zijn geen referentiewaarden beschikbaar; zie voorgaande tekst. De referentiewaarden worden landelijk bepaald en regelmatig herzien. De meest recente zijn op de website van de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC) te vinden.
Overigens zijn die normale waarden binnen de HPT-as sterk individueel verschillend. Er is volgens Deens onderzoek zelfs sprake van een uniek instelpunt dat varieert van persoon tot persoon. Iemand kan bij zeer kleine afwijkingen van zijn setpoint al symptomen ervaren terwijl de schildklierwaarden keurig binnen de normale waarden liggen. Dat individuele setpoint is bij de meeste mensen niet bekend, omdat er pas wordt gemeten als iemand met klachten bij de arts komt (22).
Vanuit biologisch perspectief moeten referentie-intervallen worden aangepast om rekening te houden met de significante inter- en intra-individuele variatie in schildklierfunctie (13). Hoewel bekend is dat de schildklierfunctie sterk varieert met leeftijd, geslacht, etniciteit, seizoen, tijdstip, jodiumtoereikendheid van de regio, sociaaleconomische status, stressniveaus, body mass index (BMI) , aantal witte bloedcellen, menstruatiecyclus, algemene gezondheidsstatus en wordt afgegeven op een pulserende manier, worden deze factoren door clinici doorgaans niet in aanmerking genomen bij de diagnose van schildklieraandoeningen en de behandeling wordt ook niet overeenkomstig aangepast (13).
In gecompliceerde gevallen, zoals een vermoeden van een niet-schildklieraandoening of storende factoren, moet uitgebreidere laboratoriummetingen, d.w.z. totale T4, T3, een T4- of T3-opnametest en rT3 worden getest om een juiste diagnose te kunnen stellen volgens onderzoekers (22).
| Hormoon | Normaal | Struma | Graves | Hashimoto |
| TSH | 0,4 – 4 mU/L | verhoogd | verlaagd | verhoogd |
| F4 (totaal) | 64 – 154 nanomol/L | verlaagd | verhoogd | verlaagd |
| FT4 (vrij) | 8 – 26 picomol/L | verlaagd | verhoogd | verlaagd |
| T3 (totaal) | 1,2 – 3,4 nanomol/L | verlaagd | verhoogd | verlaagd |
| FT3 (vrij) | 3 – 8 picomol/L |
Aandachtspunten schildklierstoornissen
Hieronder een opsomming en overzicht waar rekening mee dient te worden gehouden, om grip te krijgen op gezondheidsproblemen omtrent de schildklier en het schildklierhormoon.
1. Nutriënten
Gebrek aan essentiële voedingsstoffen komen veel voor en oorzaak van schildklierstoornissen en andere ziekten en staat in de weg van een goede gezondheid. Jodium, selenium, omega-3-vetzuren EPA en DHA, ijzer, vitamine B3 en zink zijn nodig voor de productie van het schildklierhormoon.
Oplossing: Aanvullen met supplementen of voeding. Bij verminderde functie van het schildklierhormoon overweeg kant en klaar schildklierhormoon te eten (T2) dat te vinden is in reptielen, insecten, amfibieën en schelp-/schaaldieren.
2. Ontsteking en centrale ontregeling (van de hypothalamus)
Chronische ontsteking put het lichaam uit en brengt het lichaam in een economische zuinig stand – een laaggradige ontsteking. Andere hypothalamus-hypofyse-hormoonassen worden ook vaak aangetast bij centrale hypothyreoïdie (23).
Oplossing: Laaggradige (systemische) onsteking en specifieke ontstekingsbron(nen) verhelpen. Er dient te worden rekening gehouden met ontregeling van andere systemen en lichaams(stress)assen.
3. Voedingsmiddelen of medicatie
Corticosteroiden (prednisolon of prednison) remmen de TSH-afgifte en de omzetting van T4 naar T3. Oestrogenen, orale anticonceptie, NSAID’s (pijnstillers en onstekingsremmers), middelen tegen hartritmestoornissen, bètablokkers, en fenytoine verhinderen de binding van het schildklierhormoon aan zijn transporteiwit (Thyroxine-binding Globulin, TBG) (23).
Oplossing: In overleg met uw arts eventueel vervanging vinden of verlagen medicatie.
4. Leverproblemen en diabetes
Een groot deel van de T3 wordt geproduceerd in de lever en het niet goed functioneren van dit orgaan heeft ook effect op voldoende aanmaak van T3.
Oplossing: Let op alcohol en energiedrankjes. Gebuik artisjokken, wilde artisjok of mariadistel die behoren tot de hormetische planten die globaal alle leverfuncties stimuleren. Los NAFLD op (leververvetting), waarvan de centrale oorzaak een westerse leefstijl is: hoog calorisch, ongezonde voeding, dranken met suiker, weinig bewegen en wederom genoemd, alcohol!
5. Vergif en onnatuurlijke stoffen
Zware metalen, PCB’s, triclosan, BPA (bisphenol A), ftalaten en PBDEs belasten ons lichaam en ons capaciteit om te ontgiften is niet oneindig. Daarnaast verstoren stoffen zoals fluoride (tandpasta), (per)chloraat, nitraat en thiocyanaat de jodiumopname. Probeer deze stoffen zoveel mogelijk te vermijden door natuurlijke producten te eten en te gebruiken.
Over de auteur

Drs. Sjoerd Knobben, is psycholoog en klinische PsychoNeuroImmunologische therapeut, trainer in mindfulness, martial arts (o.a. Kung Fu) en voorzitter bestuur kPNI.nl. Alles komt samen in zijn praktijk voor zelf-actualisatie en gezondheid, Upotential.
Wetenschappelijke bronnen
(1). Mantzouratou, P., Lavecchia, A. M., & Xinaris, C. (2021). Thyroid Hormone Signalling in Human Evolution and Disease: A Novel Hypothesis. Journal of clinical medicine, 11(1), 43. https://doi.org/10.3390/jcm11010043
(2). R.H. Verheesen en C.M. Schweitzer (2008). Het Jodiumtekort is Terug. medischcontact. Retrieved May 23, 2022, from https://www.medischcontact.nl/nieuws/laatste-nieuws/artikel/het-jodiumtekort-is-terug.htm
(3). Keestra, S., Högqvist Tabor, V., & Alvergne, A. (2020). Reinterpreting patterns of variation in human thyroid function: An evolutionary ecology perspective. Evolution, medicine, and public health, 9(1), 93–112. https://doi.org/10.1093/emph/eoaa043
(4). Brahney, J., Mahowald, N., Prank, M., Cornwell, G., Klimont, Z., Matsui, H., & Prather, K. A. (2021). Constraining the atmospheric limb of the plastic cycle. Proceedings of the National Academy of Sciences of the United States of America, 118(16), e2020719118. https://doi.org/10.1073/pnas.2020719118
(5). Nanoplastic pollution found at both of Earth’s poles for first time. (2022). The Guardian. https://www.theguardian.com/environment/2022/jan/21/nanoplastic-pollution-found-at-both-of-earths-poles-for-first-time
(6). Nws, V. (2022, 25 maart). Plasticdeeltjes voor het eerst gevonden in ons bloed, gezondheidseffecten nog onduidelijk. vrtnws.be. Geraadpleegd op 26 mei 2022, van https://www.vrt.be/vrtnws/nl/2022/03/25/microplastics-in-bloedbaan/
(7). Babić Leko M, Gunjača I, Pleić N, Zemunik T. Environmental Factors Affecting Thyroid-Stimulating Hormone and Thyroid Hormone Levels. Int J Mol Sci. 2021;22(12):6521. Published 2021 Jun 17. doi:10.3390/ijms22126521
(8). Kheradpisheh, Z., Mirzaei, M., Mahvi, A. H., Mokhtari, M., Azizi, R., Fallahzadeh, H., & Ehrampoush, M. H. (2018). Impact of Drinking Water Fluoride on Human Thyroid Hormones: A Case- Control Study. Scientific reports, 8(1), 2674. https://doi.org/10.1038/s41598-018-20696-4
(9). Kvetny, J., Heldgaard, P. E., Bladbjerg, E. M., & Gram, J. (2004). Subclinical hypothyroidism is associated with a low-grade inflammation, increased triglyceride levels and predicts cardiovascular disease in males below 50 years. Clinical endocrinology, 61(2), 232–238. https://doi.org/10.1111/j.1365-2265.2004.02088.x
(10). Vermiglio, F., Lo Presti, V. P., Moleti, M., Sidoti, M., Tortorella, G., Scaffidi, G., Castagna, M. G., Mattina, F., Violi, M. A., Crisà, A., Artemisia, A., & Trimarchi, F. (2004). Attention deficit and hyperactivity disorders in the offspring of mothers exposed to mild-moderate iodine deficiency: a possible novel iodine deficiency disorder in developed countries. The Journal of clinical endocrinology and metabolism, 89(12), 6054–6060. https://doi.org/10.1210/jc.2004-0571
(11). Velasco, I., Bath, S. C., & Rayman, M. P. (2018). Iodine as Essential Nutrient during the First 1000 Days of Life. Nutrients, 10(3), 290. https://doi.org/10.3390/nu10030290
(12). Stenzel, D., & Huttner, W. B. (2013). Role of maternal thyroid hormones in the developing neocortex and during human evolution. Frontiers in neuroanatomy, 7, 19. https://doi.org/10.3389/fnana.2013.00019
(13). Keestra, S., Högqvist Tabor, V., & Alvergne, A. (2020). Reinterpreting patterns of variation in human thyroid function: An evolutionary ecology perspective. Evolution, medicine, and public health, 9(1), 93–112. https://doi.org/10.1093/emph/eoaa043
(14). Donnay, S., Arena, J., Lucas, A., Velasco, I., Ares, S., & Working Group on Disorders Related to Iodine Deficiency and Thyroid Dysfunction of the Spanish Society of Endocrinology and Nutrition (2014). Iodine supplementation during pregnancy and lactation. Position statement of the working group on disorders related to iodine deficiency and thyroid dysfunction of the Spanish Society of Endocrinology and Nutrition. Endocrinologia y nutricion : organo de la Sociedad Espanola de Endocrinologia y Nutricion, 61(1), 27–34. https://doi.org/10.1016/j.endonu.2013.05.004
(15). Pérez-López F. R. (2007). Iodine and thyroid hormones during pregnancy and postpartum. Gynecological endocrinology : the official journal of the International Society of Gynecological Endocrinology, 23(7), 414–428. https://doi.org/10.1080/09513590701464092
(16). Galli, E., Marchini, M., Saba, A., Berti, S., Tonacchera, M., Vitti, P., Scanlan, T. S., Iervasi, G., & Zucchi, R. (2012). Detection of 3-iodothyronamine in human patients: a preliminary study. The Journal of clinical endocrinology and metabolism, 97(1), E69–E74. https://doi.org/10.1210/jc.2011-1115
(17). Nadol’nik L. I. (2010). Biomeditsinskaia khimiia, 56(4), 443–456.
(18). Schlenker E. H. (2012). Effects of hypothyroidism on the respiratory system and control of breathing: Human studies and animal models. Respiratory physiology & neurobiology, 181(2), 123–131. https://doi.org/10.1016/j.resp.2012.02.007
(19). Boelen, A., Kwakkel, J., & Fliers, E. (2011). Beyond low plasma T3: local thyroid hormone metabolism during inflammation and infection. Endocrine reviews, 32(5), 670–693. https://doi.org/10.1210/er.2011-0007
(20). Feldt-Rasmussen, U., Effraimidis, G., & Klose, M. (2021). The hypothalamus-pituitary-thyroid (HPT)-axis and its role in physiology and pathophysiology of other hypothalamus-pituitary functions. Molecular and cellular endocrinology, 525, 111173. https://doi.org/10.1016/j.mce.2021.111173
(21). Brent G. A. (2008). Clinical practice. Graves’ disease. The New England journal of medicine, 358(24), 2594–2605. https://doi.org/10.1056/NEJMcp0801880
(22). Andersen, S., Pedersen, K. M., Bruun, N. H., & Laurberg, P. (2002). Narrow individual variations in serum T(4) and T(3) in normal subjects: a clue to the understanding of subclinical thyroid disease. The Journal of clinical endocrinology and metabolism, 87(3), 1068–1072. https://doi.org/10.1210/jcem.87.3.8165
(23). Pappa, T. A., Vagenakis, A. G., & Alevizaki, M. (2011). The nonthyroidal illness syndrome in the non-critically ill patient. European journal of clinical investigation, 41(2), 212–220. https://doi.org/10.1111/j.1365-2362.2010.02395.x





