- Lekkende darm (leaky gut) en andere barrières
- Geassocieerde symptomen lekkende darm:
- Geassocieerde ziektebeelden lekkende darm:
- Lekkende darm (leaky gut)
- Beschermende barrières als ‘poort van het lichaam’
- Te grote doorlaatbaarheid
- Gezondheid (en ziekte) begint in de darm
- Het proces en ontstaan van ‘Leaky Gut Syndrome’
- De relatie tussen mens en plant: effect van voedingsmiddelen
- De drie meest voorkomende overlevingsstrategieën in de plantenwereld
- Co-evolutie
- Conclusie
- Over de auteur:
“De dood zit in de darm”
-Chinese gezegde
Lekkende darm (leaky gut) en andere barrières
Geassocieerde symptomen lekkende darm:
- Cariers
- Chronische vermoeidheid
- Diarree
- Futloosheid
- Kortademigheid
- Onzuivere huid
- Slaapproblemen
- Stemmingswisselingen
- Verstopping
- Winderigheid
- Zuurbranden
Geassocieerde ziektebeelden lekkende darm:
- Acne
- Allergie
- Alzheimer
- Astma/bronchitis
- Autisme
- Chronisch vermoeidheidssyndroom
- Colitis Ulcerosa
- Depressie
- Diabetes Mellitus type 1
- Eczeem
- Hart- en vaataandoeningen
- Migraine
- Ziekte van Bechterew
- Ziekte van Crohn
- Multiple Sclerose
- Voedselallergie
- Psoriasis
- Reumatoide arthritis
- Schizofrenie
- Urticaria
- Coeliakie
Lekkende darm (leaky gut)
Bij een lekkende darm hebben we het over ‘leaky barrières’. Dit is een verzamelbegrip voor verhoogde doorlaatbaarheid van de slijmvliezen die direct communiceren met de buitenwereld, zoals bijvoorbeeld het maagdarmkanaal. Dat we door onze huid worden beschermd is duidelijk, maar dit geldt dus ook voor de wegen die voedsel en lucht door ons lichaam afleggen. Deze zijn namelijk bekleed met – deels doorlaatbare – weefsellagen.
Beschermende barrières als ‘poort van het lichaam’
De weefsellagen in de darm maar ook op de huid, longen en mond kun je zien als beschermende barrières. Het lichaam maakt een afweging in doorlaatbaarheid aangezien zuurstof en voedingsstoffen van buiten het lichaam worden opgenomen. Tegelijkertijd geeft deze doorlaatbaarheid een risico op het binnendringen van schadelijke stoffen (toxines) en bacteriën, virussen of schimmels (pathogenen). De beschermwand vormt de eerste verdedigingslinie van het afweersysteem. Voeding bevindt zich pas in het lichaam als het verteerd en wel via de darmwand is opgenomen.
Het belang van de verschillende barrières is evenredig met het oppervlak. Zo is die van de huid met twee vierkante meter klein, terwijl die op het oog groot lijkt. De longen zijn met 100 m2 al een stuk groter. Met meer dan 500 m2 is het oppervlak van het spijsverteringskanaal samen met de mondholte de allergrootste. Dit enorme oppervlak maakt het mogelijk om zoveel mogelijk voedingstoffen op te nemen, maar maakt het dus ook kwetsbaar voor het binnendringen van toxinen en pathogenen.
Te grote doorlaatbaarheid
De meeste inwoners van westerse geïndustrialiseerde landen lijden vermoedelijk aan een te grote doorlaatbaarheid van hun slijmvliezen. Met name die van de mondholte en darm (lekkende darm). Het gevolg is dat stoffen uit de ontlasting, toxinen en pathogenen ongecontroleerd in de bloedsomloop terecht kunnen komen (2,3). De meest betrouwbare test om deze diagnose vast te stellen (naast het evalueren van de klinische verschijnselen en aandoeningen) is de 13C-Sucrose-Ademtest (4).
Gezondheid (en ziekte) begint in de darm
Onze darmen zijn acht meter lang, herbergen 80% van het immuunsysteem (de b-lymfocyten en de bijbehorende immunoglobulinen) en leveren meer dan 90% van het lichaamseigen ‘gelukshormoon’ serotonine (5). Het is een complexe, meerlagige beschermingswand die begint bij de mond en eindigt bij de anus. De darm beschermt ons tegen ziekteverwekkers en regelt de opname van voeding.
Ontelbare studies hebben laten zien dat een groot deel van bekende aandoeningen hun directe oorzaak in de darm hebben of dat deze er een grote rol in speelt. Zoals allergieën, (6), Astma (6), coeliakie (7), het chronisch vermoeidheidssyndroom (8), de ziekte van Crohn (9), depressie (10), diabetes mellitus type 1(11), de ziekte van Hashimoto, migraine (12), multiple sclerose (13), psoriasis (14), reumatoïde artritis (15), hart- en vaatziekten (16) en de ziekte van alzheimer (17). Aan de hand van de darm zullen we een beeld schetsen van de belangrijkste negatieve en positieve invloeden op onze barrières.
Het proces en ontstaan van ‘Leaky Gut Syndrome’
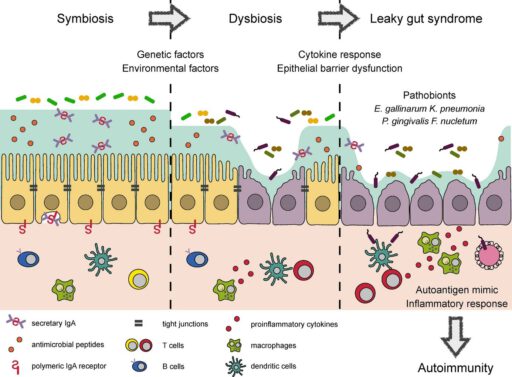
Onderstaande afbeelding uit geeft het ontstaan van leaky gut weer. In een gezonde darm leeft een symbiotische darmflora, waarbij ‘goede’ bacteriën in balans met ons leven, waarbij de darmwand (tight junctions) op elkaar zijn aangesloten. Door genetische en omgevingsfactoren (stress, voeding, et cetera) ontstaat een dysbiose. Hierbij krijgen schadelijke bacteriën de overhand en kunnen zelfs bepaalde goede bacteriën schadelijk voor ons worden. De darmwand, de ‘Tight junctions’ gaan over verloop van tijd steeds meer kapot en er ontstaan minuscule gaten in de darmwand, ofwel een lekkende darm. Dat heeft meerdere negatieve gevolgen dat volgt met immuunreactie, auto-immuniteit en ziekte.
De relatie tussen mens en plant: effect van voedingsmiddelen
Om de invloed van voedingsmiddelen op ons spijsverteringssysteem te begrijpen, moeten we de plantenwereld nauwkeuriger bekijken.
Om niet uit te sterven, beschermen planten zichzelf en hun ‘nakomelingen’. Planten zijn er al ongeveer 460 miljoen jaar, mensachtige primaten pas ongeveer 25 miljoen jaar. Planten hebben dus veel tijd gehad om hun overlevingsstrategieën te ontwikkelen en manieren te vinden om hun zaden zo goed mogelijk te verspreiden. Deze strategieën zijn ontwikkeld om de plant de mogelijkheid te geven zich voort te planten. Dit is evolutionaire biologisch gezien de belangrijkste taak, niet alleen voor planten, maar voor alle levende wezens op aarde. Zoals straks te lezen valt, hebben deze beschermende mechanismen van planten een impact op onze darmbarrière.
De drie meest voorkomende overlevingsstrategieën in de plantenwereld
- Planten met een vlezige vrucht (zoals, appels peren, mango’s en abrikozen) hebben smakelijk vruchtvlees en een vrij onverteerbare pit. Hierbij ‘hoopt’ de plant uitgescheiden te worden op een verder gelegen plek om te kunnen ontkiemen.
- Bij de derde strategie beschermt de plant het zaad met eigen gifstoffen (anti- nutriënten). Deze stoffen worden vooral onder de schil bewaard. Ze moeten bacteriën, insecten en schimmels doden, verteringsenzymen remmen, de darmwand van insecten doorbreken en zorgen dat andere gifstoffen vrijkomen.
- Deze laatste strategie heeft bij grotere dieren en mensen echter maar een beperkt succes. Met name bij ons als mensen, omdat we leerden koken. De afweerstoffen van planten met deze strategie hebben dus vaak geen merkbaar effect op ons. Uit steeds meer onderzoek blijkt nu dat de dagelijkse consumptie van zulke planten met allerlei aandoeningen in verband kan worden gebracht (18).
De mogelijke toxiciteit van bepaalde planten en hun werkzame stoffen is niet altijd merkbaar. Dit maakt het moeilijk om een goede uitspraak te doen over de eventuele schadelijke werking. Een goed voorbeeld zijn gliadines (deeleiwitten van gluten); morfineachtige stoffen die door gedeeltelijk vertering vrijgezet worden. Hun mogelijk schadelijke werking in de darmen kunnen kan onmerkbaar zijn. Het blijkt dat 87% van mensen die glutenintolerant is, dit niet merkt. Ze lijden aan aandoeningen die op het eerste gezicht niets met gluten te maken lijken te hebben. Gliadines zijn dus een soort van silent factor bij aandoeningen zoals autisme, hart- en vaatziekten en auto immuunziekten, zonder dat de patiënt problemen lijkt te hebben op het gebied van het maag-darmkanaal (19).
Co-evolutie
De giftigheid van de aparte onderdelen van een plant kan sterk verschillen. De wortels en hun beschermingsstoffen zijn alleen bij bepaalde plantensoorten (vooral knollen) schadelijk. Bladeren en steel zijn voor mensen vaak het minst belastend of zelfs juist gezondheidsbevorderend. Ditzelfde geldt mogelijk voor een aantal zogenaamde hormetische stoffen in ‘toxische’ planten. Goede voorbeelden zijn resveratrol (rode wijn etc.), curcumine in geelwortel, capsaïcine in chilipepers en allicine in knoflook.
Dit hebben wij te ‘danken’ aan dat onze voorouders deze planten lange perioden in onze historie gegeten hebben, waardoor onze lichaamscellen getraind zijn om stoffen te produceren die het lichaam sterker maakt. Een goed onderzocht molecuul en mechanisme is nrf2. Nrf2 speelt een belangrijke rol in de regulatie van ons metabolisme, ontsteking, autophagy, proteostasis, mitochondriale fysiologie en immune reactie (27).
Er zijn ook vele planten die in het westerse dieet zitten, die de mens nog niet zo lang eet en waarop we dus nog niet zo goed zijn aangepast. Hier zitten geen gunstige effecten aan verbonden zoals nrf2 en geven juist een ongunstig effect via immuunactivatie. Goede voorbeelden hiervan zijn soja en granen. De giftigheid en of we er daadwerkelijk merkbaar last van krijgen heeft te maken met een genetisch kwetsbaarheid, gezondheidsstatus, maar ook met de bereidingswijze en hoeveel er van gegeten wordt. De dosering maakt het vergif is een belangrijke wijsheid die op voeding zeer van toepassing is. Dit vergif merken velen mensen helaas pas decennia later wanneer hun lichaam en darmen gezondheid al in grote mate is beschadigd.
Conclusie
Dichte barrieres en een normale darmflora vormen het fundament voor een goede gezondheid en de genezing van bijna alle ziekten.
Naast een optimale voeding en een reductie van alle negatieve invloeden kunnen diverse stoffen worden ingezet, zoals een probioticum, lactoferinne (een onstekingsremmend eiwit dat pathogenen bacterien afbreekt), de eiwitbouwstof glutamine en zink (belangrijke bijrol) (21-24). Een combinatie van deze vier interventies is volgens recente onderzoeksresultaten zeer veelbelovend (25-26).
Veel informatie uit deze tekst is afkomst uit “Word weer mens. De terugkeer van homo sapiens” door dr. L. Pruimboom. Vindt in dit boek verdere informatie betreffende dit onderwerp.
Over de auteur:

Drs. Sjoerd Knobben, ‘eeuwige student van het leven’ is psycholoog en klinische PsychoNeuroImmunologische therapeut, docent bij PNI europe, trainer in mindfulness, martial arts (o.a. kung fu) en voorzitter bestuur kPNI.nl. Alles komt samen in zijn praktijk voor zelf-actualisatie en gezondheid, genaamd Upotential.
Upotential.nl kpni.nl cpnieurope.nl ivmv.org
Bronnen
(1) Thayer, J. F., & Sternberg, E. M. (2010). Neural aspects of immunomodulation: focus on the vagus nerve. Brain, behavior, and immunity, 24(8), 1223–1228. https://doi.org/10.1016/j.bbi.2010.07.247
(2) Hawkesworth, S., Moore, S. E., Fulford, A. J., Barclay, G. R., Darboe, A. A., Mark, H., Nyan, O. A., & Prentice, A. M. (2013). Evidence for metabolic endotoxemia in obese and diabetic Gambian women. Nutrition & diabetes, 3(8), e83. https://doi.org/10.1038/nutd.2013.24
(3) Maes, M., Kubera, M., Obuchowiczwa, E., Goehler, L., & Brzeszcz, J. (2011). Depression’s multiple comorbidities explained by (neuro)inflammatory and oxidative & nitrosative stress pathways. Neuro endocrinology letters, 32(1), 7–24.
(4) Gibson, R. J., & Bowen, J. M. (2011). Biomarkers of regimen-related mucosal injury. Cancer treatment reviews, 37(6), 487–493. https://doi.org/10.1016/j.ctrv.2011.05.007
(5) Berger, M., Gray, J. A., & Roth, B. L. (2009). The expanded biology of serotonin. Annual review of medicine, 60, 355–366. https://doi.org/10.1146/annurev.med.60.042307.110802
(6) Liu, Z., Li, N., & Neu, J. (2005). Tight junctions, leaky intestines, and pediatric diseases. Acta paediatrica (Oslo, Norway : 1992), 94(4), 386–393. https://doi.org/10.1111/j.1651-2227.2005.tb01904.x
(7) Schulzke, J. D., Bentzel, C. J., Schulzke, I., Riecken, E. O., & Fromm, M. (1998). Epithelial tight junction structure in the jejunum of children with acute and treated celiac sprue. Pediatric research, 43(4 Pt 1), 435–441. https://doi.org/10.1203/00006450-199804000-00001
(8) Maes, M., Twisk, F. N., Kubera, M., Ringel, K., Leunis, J. C., & Geffard, M. (2012). Increased IgA responses to the LPS of commensal bacteria is associated with inflammation and activation of cell-mediated immunity in chronic fatigue syndrome. Journal of affective disorders, 136(3), 909–917. https://doi.org/10.1016/j.jad.2011.09.010
(9) Caradonna, L., Amati, L., Magrone, T., Pellegrino, N. M., Jirillo, E., & Caccavo, D. (2000). Enteric bacteria, lipopolysaccharides and related cytokines in inflammatory bowel disease: biological and clinical significance. Journal of endotoxin research, 6(3), 205–214.
(10) Maes, M., Kubera, M., & Leunis, J. C. (2008). The gut-brain barrier in major depression: intestinal mucosal dysfunction with an increased translocation of LPS from gram negative enterobacteria (leaky gut) plays a role in the inflammatory pathophysiology of depression. Neuro endocrinology letters, 29(1), 117–124.
(11) Sapone, A., de Magistris, L., Pietzak, M., Clemente, M. G., Tripathi, A., Cucca, F., Lampis, R., Kryszak, D., Cartenì, M., Generoso, M., Iafusco, D., Prisco, F., Laghi, F., Riegler, G., Carratu, R., Counts, D., & Fasano, A. (2006). Zonulin upregulation is associated with increased gut permeability in subjects with type 1 diabetes and their relatives. Diabetes, 55(5), 1443–1449. https://doi.org/10.2337/db05-1593
(12) Amery, W. K., & Forget, P. P. (1989). The role of the gut in migraine: the oral 51-Cr EDTA test in recurrent abdominal pain. Cephalalgia : an international journal of headache, 9(3), 227–229. https://doi.org/10.1046/j.1468-2982.1989.0903227.x
(13) Yacyshyn, B., Meddings, J., Sadowski, D., & Bowen-Yacyshyn, M. B. (1996). Multiple sclerosis patients have peripheral blood CD45RO+ B cells and increased intestinal permeability. Digestive diseases and sciences, 41(12), 2493–2498. https://doi.org/10.1007/BF02100148
(14) Hamilton, I., Fairris, G. M., Rothwell, J., Cunliffe, W. J., Dixon, M. F., & Axon, A. T. (1985). Small intestinal permeability in dermatological disease. The Quarterly journal of medicine, 56(221), 559–567.
(15) Smith, M. D., Gibson, R. A., & Brooks, P. M. (1985). Abnormal bowel permeability in ankylosing spondylitis and rheumatoid arthritis. The Journal of rheumatology, 12(2), 299–305.
(16) Orr, J. S., Gentile, C. L., Davy, B. M., & Davy, K. P. (2008). Large artery stiffening with weight gain in humans: role of visceral fat accumulation. Hypertension (Dallas, Tex. : 1979), 51(6), 1519–1524. https://doi.org/10.1161/HYPERTENSIONAHA.108.112946
(17) Buchanan, M. M., Hutchinson, M., Watkins, L. R., & Yin, H. (2010). Toll-like receptor 4 in CNS pathologies. Journal of neurochemistry, 114(1), 13–27. https://doi.org/10.1111/j.1471-4159.2010.06736.x
(18) de Punder, K., & Pruimboom, L. (2013). The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients, 5(3), 771–787. https://doi.org/10.3390/nu5030771
(19) Pruimboom, L., & de Punder, K. (2015). The opioid effects of gluten exorphins: asymptomatic celiac disease. Journal of health, population, and nutrition, 33, 24. https://doi.org/10.1186/s41043-015-0032-y
(20) Ilchmann-Diounou, H., & Menard, S. (2020). Psychological Stress, Intestinal Barrier Dysfunctions, and Autoimmune Disorders: An Overview. Frontiers in immunology, 11, 1823. https://doi.org/10.3389/fimmu.2020.01823
(21) Kinashi, Y., & Hase, K. (2021). Partners in Leaky Gut Syndrome: Intestinal Dysbiosis and Autoimmunity. Frontiers in immunology, 12, 673708. https://doi.org/10.3389/fimmu.2021.673708
(22) Teanpaisan, R., Piwat, S., & Dahlén, G. (2011). Inhibitory effect of oral Lactobacillus against oral pathogens. Letters in applied microbiology, 53(4), 452–459. https://doi.org/10.1111/j.1472-765X.2011.03132.x
(23) Koduganti, R. R., Sandeep, N., Guduguntla, S., & Chandana Gorthi, V. S. (2011). Probiotics and prebiotics in periodontal therapy. Indian journal of dental research : official publication of Indian Society for Dental Research, 22(2), 324–330. https://doi.org/10.4103/0970-9290.84312 (Retraction published Indian J Dent Res. 2012 Sep-Oct;23(5):682)
(24) Berlutti, F., Pilloni, A., Pietropaoli, M., Polimeni, A., & Valenti, P. (2011). Lactoferrin and oral diseases: current status and perspective in periodontitis. Annali di stomatologia, 2(3-4), 10–18.
(25) Suzuki, K., Miyamoto, T., Miyamoto, M., Kaji, Y., Takekawa, H., & Hirata, K. (2007). Circadian variation of core body temperature in Parkinson disease patients with depression: a potential biological marker for depression in Parkinson disease. Neuropsychobiology, 56(4), 172–179. https://doi.org/10.1159/000119735
(26) Ono, T., Murakoshi, M., Suzuki, N., Iida, N., Ohdera, M., Iigo, M., Yoshida, T., Sugiyama, K., & Nishino, H. (2010). Potent anti-obesity effect of enteric-coated lactoferrin: decrease in visceral fat accumulation in Japanese men and women with abdominal obesity after 8-week administration of enteric-coated lactoferrin tablets. The British journal of nutrition, 104(11), 1688–1695. https://doi.org/10.1017/S0007114510002734
(27) He, F., Ru, X., & Wen, T. (2020). NRF2, a Transcription Factor for Stress Response and Beyond. International journal of molecular sciences, 21(13), 4777. https://doi.org/10.3390/ijms21134777





