Psoriasis en het leaky gut syndrome
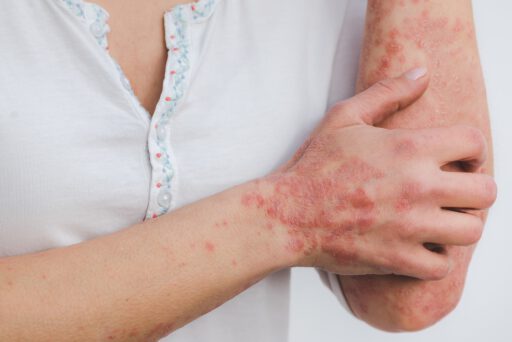
Psoriasis is bij de meeste mensen zichtbaar in huidproblemen. Dit is helaas echter maar het topje van de ijsberg. Het overgrote stuk van de ijsberg bestaat in dit geval uit een aantal verschillende verstoorde werkingsmechanismen in je lichaam. Hierbij beschouwen we problemen in de darmen, vooral een leaky gut, inmiddels als één van de fundamenten van die ijsberg. In deze blog gaan we kijken hoe de relatie zit tussen het functioneren van de darm en psoriasis.
Waar hebben we het over?
Psoriasis is een aandoening die vooral in Westerse landen voorkomt, die verder van de evenaar af liggen. In 90% van de gevallen is er sprake van psoriasis vulgaris die zichtbaar is in een droge, schilferige en verheven huid, met name op de ellebogen, knieën, tussen het hoofdhaar en op de lage gedeelten van de rug. De informatie in deze blog geldt overigens niet alleen voor deze, maar ook voor de andere uitingsvormen van psoriasis in de huid en de gewrichten.
Psoriasis is een systemische ziekte.
Dat wil zeggen dat de aandoening niet beperkt is tot één orgaan of lichaamsdeel, maar dat verschillende organen of orgaansystemen erbij betrokken zijn. In het geval van psoriasis is in ieder geval duidelijk dat zowel het aangeboren als het verworven afweersysteem niet optimaal functioneren. Eerst is er sprake van een initiatiefase, waarbij een infectie, huidschade of specifieke medicatie het aangeboren afweersysteem triggeren. Daarna ontstaat er een zichzelf versterkend proces van ontstekingen, vorming van zelf-antigenen* en het voortduren van het ontstekingsproces (chronificatie). Het specifieke afweersysteem dat ons normaal beschermt tegen intracellulaire pathogenen, zoals virussen – het Th-1-systeem – speelt hierin een centrale rol. In een later stadium verergeren onder andere het Th-17 en Th-22 systeem de situatie.
Gerelateerde aandoeningen
Een aantal aandoeningen kan in combinatie met psoriasis optreden (comorbiditeiten). Zo is de kans op aandoeningen die vallen onder het metabool syndroom (verhoogde bloeddruk, overgewicht, verhoogde bloedvetten, insulineresistentie) verhoogd. Daarnaast komen aandoeningen zoals depressie, fibromyalgie, COPD en inflammatoire darmziekten vaker voor bij mensen met psoriasis. Voor veel van deze aandoeningen geldt bovendien: hoe ernstiger de psoriasis, hoe sterker deze relatie.
Een ‘lekke darm’ als oorzaak (en consequentie)
Zowel bij psoriasis, als bij de hierboven genoemde comorbiditeiten van psoriasis is er sprake van een duidelijke relatie met een stoornis in het functioneren van de darm. Gemeenschappelijke deler is een ondermaatse barrièrefunctie van de darmwand, waardoor er stoffen de bloedbaan in kunnen komen die vervolgens leiden tot systemische activatie van het afweersysteem. Dit wordt omschreven als een ‘leaky gut’. Andere termen hiervoor zijn: een verhoogde intestinale permeabiliteit, of in gewoon Hollands: een lekke darm.
Hoe een ‘leaky gut’ ontsteking kan opstoken
Eén van de manieren waarop zo’n lekke darm het ontstekingsproces bij psoriasis kan opstoken is via een endotoxemie. Hierbij komen Lipopolysacchariden (LPS), aanwezig op verschillende bacteriën in de darm onbedoeld in de bloedbaan terecht. Deze LPS worden herkend door specifieke receptoren van onder andere macrofagen. Deze cellen van het aangeboren afweersysteem zetten een cascade van verschillende ontstekingsprocessen op gang en (her)activeren het specifiek afweersysteem.
Een complicerende factor is dat de verschillende stappen die leiden tot een leaky gut en systemische activatie van het afweersysteem elkaars gevolg kunnen zijn. Systemische activatie van het afweersysteem (bijvoorbeeld door de cytokinen, ofwel ontsteking-communicatie-stofjes, die vrijkomen bij psoriasis), kunnen leiden tot een leaky gut, wat weer kan leiden tot een systemische activatie van het afweersysteem en daardoor een verhoogde hoeveelheid van cytokinen in het bloed. In dit proces spelen overigens nog meer factoren een rol, waaronder vooral het microbioom van de darm een belangrijke is.
De darmbarrière weer gezond krijgen
Wat kunnen we doen om de darmwand weer gezond en robuust te krijgen?
- Wat we in ieder geval weten, is dat een beter functionerende darmwand bij patiënten met psoriasis tot een lage ziekteactiviteit leidt. De darmwand kan versterkt worden door slim te eten en gericht gebruik te maken van supplementen.
- Gewichtsafname en het verbeteren van de leverfunctie zorgen ook voor een beter functionerende darmbarrière en vermindering van klachten bij psoriasis. Hierbij komt het bijvoorbeeld aan op het goed timen van beweeg- en eetmomenten.
- De samenstelling van de microbiota van de darm is ook een sleutel tot het verbeteren van de darmfunctie en het verminderen van de ontstekingsgevoeligheid. Door te ‘darmtuinieren’ creëer je optimale omstandigheden voor de goede bacteriën, vergroot je de variatie aan verschillende bacteriën en kun je het aantal pro-inflammatoire bacteriën verminderen. Ook andere leefstijlinterventies en gericht gebruik van pre- en probiotica kunnen helpen.
- Activatie van stress en ontspannings-systemen heeft via verschillende wegen invloed op de darmfunctie. Vaak zijn ook hier individuele veranderstappen te maken die de situatie verbeteren.
Persoonlijk advies
Heb je last van psoriasis en wil je ontrafelen hoe de ijsberg er bij jou mogelijk uitziet en welke veranderstappen je mogelijk kunnen helpen?
*Zelf-antigenen (self-antigenes) zijn hele kleine stukjes lichaamseigen materiaal, vaak niet meer dan enkele eiwitbouwstenen groot, die door het afweersysteem abusievelijk als lichaamsvreemd worden beschouwd. Bijvoorbeeld doordat ze erg lijken op lichaamsvreemd materiaal dat elders in het lichaam tot activatie van het afweersysteem heeft geleid.
Over de auteur
Henk-Jan Dolsma heeft een praktijk in Zuidwolde (Drenthe) en werkt met veel verschillende cliënten aan kwaliteit van leven, gezondheid en belastbaarheid. Vanuit een persoonsgerichte benadering maakt hij hierbij gebruik van diverse leefstijlfactoren zoals voeding, beweging, ontspanning en mindset.

Bronnen
Parisi, R., Iskandar, I. Y. K., Kontopantelis, E., Augustin, M., Griffiths, C. E. M., & Ashcroft, D. M. (2020). National, regional, and worldwide epidemiology of psoriasis: Systematic analysis and modelling study. In The BMJ (Vol. 369). https://doi.org/10.1136/bmj.m1590
Zelman, M., Tompary, E., Raymond, J., Holdaway, P., Mulvihill, M. L. (2015). Pathologie, zevende herziene Nederlandse editie (H. Groenewoud (ed.); 7th ed.). Pearson Benelux.
Greb, J. E., Goldminz, A. M., Elder, J. T., Lebwohl, M. G., Gladman, D. D., Wu, J. J., Mehta, N. N., Finlay, A. Y., & Gottlieb, A. B. (2016). Psoriasis. Nature Reviews Disease Primers, 2. https://doi.org/10.1038/nrdp.2016.82
Humbert, P., Bidet, A., Treffel, P., Drobacheff, C., & Agache, P. (1991). Intestinal permeability in patients with psoriasis. Journal of Dermatological Science, 2(4), 324–326. https://doi.org/10.1016/0923-1811(91)90057-5
https://nl.wikipedia.org/wiki/Metabool_syndroom
FitzGerald, O., Ogdie, A., Chandran, V., Coates, L. C., Kavanaugh, A., Tillett, W., Leung, Y. Y., deWit, M., Scher, J. U., & Mease, P. J. (2021). Psoriatic arthritis. Nature Reviews Disease Primers, 7(1). https://doi.org/10.1038/s41572-021-00293-y
Sikora, M., Stec, A., Chrabaszcz, M., Giebultowicz, J., Samborowska, E., Jazwiec, R., Dadlez, M., Olszewska, M., & Rudnicka, L. (2021). Clinical implications of intestinal barrier damage in Psoriasis. Journal of Inflammation Research, 14, 237–243. https://doi.org/10.2147/JIR.S292544
Fukui, H. (2016). Increased Intestinal Permeability and Decreased Barrier Function: Does It Really Influence the Risk of Inflammation? Inflammatory Intestinal Diseases, 1(3), 135–145. https://doi.org/10.1159/000447252
De Punder, K., & Pruimboom, L. (2015). Stress induces endotoxemia and low-grade inflammation by increasing barrier permeability. Frontiers in Immunology, 6(MAY), 1–12. https://doi.org/10.3389/fimmu.2015.00223
Hietbrink, F., Besselink, M. G. H., Renooij, W., De Smet, M. B. M., Draisma, A., Van Der Hoeven, H., & Pickkers, P. (2009). Systemic inflammation increases intestinal permeability during experimental human endotoxemia. Shock, 32(4), 374–378. https://doi.org/10.1097/SHK.0b013e3181a2bcd6
Damms-Machado, A., Louis, S., Schnitzer, A., Volynets, V., Rings, A., Basrai, M., & Bischoff, S. C. (2017). Gut permeability is related to body weight, fatty liver disease, and insulin resistance in obese individuals undergoing weight reduction. American Journal of Clinical Nutrition, 105(1), 127–135. https://doi.org/10.3945/ajcn.116.131110
Lewis, C. V., & Robert Taylor, W. (2020). Intestinal barrier dysfunction as a therapeutic target for cardiovascular disease. American Journal of Physiology – Heart and Circulatory Physiology, 319(6), H1227–H1233. https://doi.org/10.1152/AJPHEART.00612.2020
Clemente, J. C., Manasson, J., & Scher, J. U. (2018). The role of the gut microbiome in systemic inflammatory disease. BMJ (Online), 360, 1–33. https://doi.org/10.1136/bmj.j5145
Scher, J. U., Ubeda, C., Artacho, A., Attur, M., Isaac, S., Reddy, S. M., Marmon, S., Neimann, A., Brusca, S., Patel, T., Manasson, J., Pamer, E. G., Littman, D. R., & Abramson, S. B. (2015). Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. In Arthritis and Rheumatology (Vol. 67, Issue 1, pp. 128–139). https://doi.org/10.1002/art.38892
Bischoff, S. C., Barbara, G., Buurman, W., Ockhuizen, T., Schulzke, J. D., Serino, M., Tilg, H., Watson, A., & Wells, J. M. (2014). Intestinal permeability – a new target for disease prevention and therapy. BMC Gastroenterology, 14(1), 1–25. https://doi.org/10.1186/s12876-014-0189-7
Ghosh, S. S., & Ghosh, S. (2020). Intestinal Barrier Function – a Novel Target to modulate Diet-induced Metabolic Diseases. Archives of Gastroenterology Research, 1(3), 61–65. https://doi.org/10.33696/gastroenterology.1.012
Quan, Z. F., Yang, C., Li, N., & Li, J. S. (2004). Effect of glutamine on change in early postoperative intestinal permeability and its relation to systemic inflammatory response. In World Journal of Gastroenterology (Vol. 10, Issue 13, pp. 1992–1994). https://doi.org/10.3748/wjg.v10.i13.1992

